advanced science∣广东医科大学陈晓辉团队开发激活型探针用于肿瘤诊疗的新策略-和记娱乐手机版下载
近日,广东医科大学医学技术学院陈晓辉团队联合香港中文大学(深圳)唐本忠院士/深圳大学王东教授,在国际权威期刊《advanced science》发表了题为“from spark to flame: ros- and light-cascade activatable nir-ii aie probe for precise tumor imaging and self-amplifying phototherapy”的研究论文,开发了一种ros和近红外光级联激活的nir-ii aie诊疗探针,实现肿瘤的精准成像与放大光疗。

肿瘤是世界上亟待解决的主要公共健康问题之一,由于其高的发病率和转移率,迫切需要开发精准高效的诊疗策略。目前,光介导的肿瘤诊疗手段由于其非侵袭性、高时空可控性、低毒副作用等优点得到了广泛的关注。其中,光激活诊疗分子在光照下通过光化学反应,实现从暗态转变为荧光态,提高成像信噪比和灵敏度;同时其光疗惰性向光疗活性转变,提高光疗精度,降低对正常组织的毒副作用,为肿瘤的诊疗提供了新的思路。近年来,基于不同光化学反应机制的光激活荧光分子已经用于体外生物过程追踪,但是由于光激活诊疗分子的单一光响应性,在体内肿瘤部位始终处于暗态,导致无法预先诊断肿瘤的精确位置,需要预先借助其他辅助手段才能发挥有效光疗,限制了光激活类分子在体内肿瘤诊疗中的应用。因此,开发集肿瘤定位和光激活为一体的激活型诊疗分子,有望对肿瘤的精准诊断与有效治疗提供新策略。
本论文开发了基于二氢吲哚骨架的ros和光级联激活型nir-ii aie诊疗探针tt-dhin。在肿瘤微环境ros作用下,tt-dhin通过氧化脱氢反应转变为具有nir-ii发射和优异光动力/光热活性的吲哚鎓盐类分子tt-in,激活高信背比(11.5)的nir-ii荧光信号,定位肿瘤病灶,作为光激活的指引“雷达”,利用光的高时空可控性,选择性光照肿瘤区域;同时肿瘤微环境ros激活的tt-in在近红外光照射下高效产生ros,自补充到肿瘤区域,循环激活肿瘤内的tt-dhin转变为tt-in,显著地提升光疗活性,实现体外癌细胞的有效杀灭和体内肿瘤的精准消除,同时对正常组织表现出好的生物安全性。该研究提出的双重激活级联放大策略,成功将肿瘤微环境响应性与光激活机制相结合,为nir-ii成像指引的精准、高效和安全的肿瘤光疗提供了新思路,具有重要的临床转化潜力。
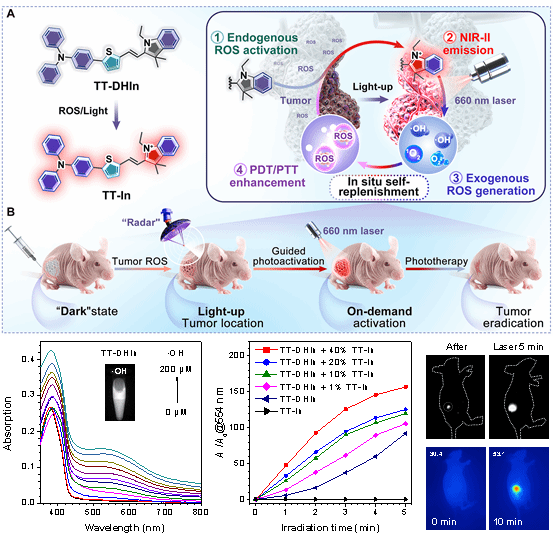
ros和光级联激活型nir-ii aie探针用于肿瘤定位与放大光疗的示意
广东医科大学为本论文的第一单位。同时获得国家自然科学基金项目(22205080, 22405063),广东省基础与应用基础研究基金(2023a1515110122, 2024a1515010677, 2024a1515012842)等项目的资助。
论文链接:https://doi.org/10.1002/advs.202514789