我校周军智在综合性顶级期刊《pnas》发表最新科研成果-和记娱乐手机版下载
进展1:
氧气对动物生命至关重要,如何感受氧气一直是科学界谜团之一。2019年诺贝尔生理学或医学奖授予了美国癌症学家william g. kaelin jr、英国医学家sir peter j. ratcliffe和美国医学家gregg l. semenza,以表彰他们在发现细胞如何感知和适应氧气供应中所做出的杰出贡献。然而,肿瘤微环境下hif1α介导的低氧通路如何被维持这一重要生物学原因尚不清晰。氧气对动物生命至关重要,如何感受氧气一直是科学界谜团之一。2019年诺贝尔生理学或医学奖授予了美国癌症学家william g. kaelin jr、英国医学家sir peter j. ratcliffe和美国医学家gregg l. semenza,以表彰他们在发现细胞如何感知和适应氧气供应中所做出的杰出贡献。然而,肿瘤微环境下hif1α介导的低氧通路如何被维持这一重要生物学原因尚不清晰。
近日,广东医科大学基础医学院周军智课题组与蔡亚非(南京农业大学)、邹永康(深圳湾实验室)合作在国际著名杂志proceedings of the national academy of sciences of the united states of america(pnas)在线发表了肿瘤低氧通路新型调控机制及新型免疫联合治疗的最新研究成果“ufmylation, a supervisor of hif1α pathway and potential therapeutic target for anti-pd-1 combination therapy in hypoxic tumors”。
该研究发现hif1α的犹素修饰 (ufmylation)对抗其泛素化降解、维持其蛋白稳定性。机制上,犹素修饰因子e3(ufl1)的缺失或 hif1α ufmylation修饰突变体均增加 hif1α 与 p53 的结合,从而促进了hif1α降解。细胞模型和动物模型显示:犹素修饰因子e1(uba5)的敲除或 hif1α ufmylation修饰突变体都会下调 hif1α 稳定性,从而显著抑制肿瘤的生长和发展。有意思的是,hif1α ufmylation修饰突变的肿瘤细胞更加响应anti-pd-1治疗。uba5 在乳腺癌临床组织样品中表达上调并与hif1α表达正相关,同时,uba5选择性抑制剂可降低ufmylation修饰活性和hif1α 蛋白,从而显著增强小鼠肿瘤模型中的抗 pd-1 联合治疗效果,凸显临床转化潜力。研究结果首次揭示了ufmylation修饰与低氧信号通路的独特联系,揭示了靶向hif1α ufmylation修饰可提高anti-pd-1抗体治疗这一新型肿瘤策略。值得一提的是:美国科学院院士,肿瘤低氧通路领域国际著名科学家,宾夕法尼亚大学教授m. celeste simon担任该稿件的学术编辑对该研究工作予以高度认可。
广东医科大学为第一通讯单位,周军智为最后通讯作者。该研究工作受国家自然科学基金面上项目、广东医科大学高层次人才启动经费支持。
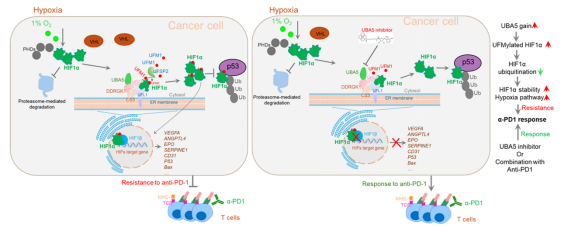
文章工作示意图 (pnas 2025)
进展2:
周军智课题组在蛋白修饰与衰老及免疫调控中也取得其他持续性进展

内皮细胞衰老是血管老化的核心推手,更是多种心血管疾病的如动脉粥样硬化、高血压、心衰等心血管疾病的“导火索”。已有研究表明,hippo-yap信号通路在内皮细胞功能的维持以及多种心血管疾病的发生发展中具有重要作用,但是yap蛋白是否能够发生犹素化修饰,以及yap的犹素化在血管内皮细胞衰老中的作用还尚不明确。
2025年2月21日,广东医科大学周军智团队与杭州师范大学汪虎团队、中南大学湘雅医院柏勇平团队共通讯在国际知名期刊iscience(cell新子刊jcr q1)上发表题为“ufmylation maintains yap stability to promote vascular endothelial cell senescence”的研究论文,发现内皮细胞yap是新型ufmylation修饰底物,该修饰增加了其蛋白稳定性。有趣的是,衰老的内皮细胞中ufmylation修饰活性增加进一步促进了的yap稳定性,进一步导致衰老内皮细胞中yap的积累,加剧内皮细胞衰老表型。靶向yap-ufmylation修饰,可以改善内皮细胞衰老,同时减轻老年小鼠的心血管衰老表型。该研究首次发现了ufmylation修饰与衰老生物学的联系,也为心血管衰老提供潜在靶点。